
一些植物和动物具备从单个体细胞发育成完整个体的能力, 即细胞全能性。在植物中, 体细胞胚胎(简称体胚) (somatic embryo)再生体现了植物细胞的全能性(Chen et al., 2024)。1902年, 德国植物学家Haberlandt (1902)提出利用已分化的植物体细胞来培养胚胎的设想, 开启了植物组织培养和细胞全能性研究。1957年, Skoog和Miller (1957)发现了植物激素调控植物离体器官发生的规律。1958年, Reinert (1958)和Steward等(1958)成功将胡萝卜(Daucus carota)皮层细胞诱导成体细胞胚, 证实了植物细胞的全能性。此后, 利用生长素(主要是人工生长素2,4-D)在多种植物中实现了体胚再生(Chen et al., 2024)。
目前, 体胚再生作为成熟技术应用于大部分单子叶植物和裸子植物的遗传转化。体胚诱导条件十分苛刻, 对外植体、培养条件及操作程序均有很高要求, 通常需要数月乃至数年的时间(Luo et al., 2025; McFarland and Kaeppler, 2025)。解析植物体胚再生的分子机制, 寻找关键调控基因并加以利用可提高体胚再生效率, 对于作物和木本植物的遗传改良具有重要意义。
体胚来自原生质体、小孢子、悬浮细胞系以及胚性愈伤组织等。根据细胞来源的差异, 植物体胚再生体系可分为间接型和直接型(Horstman et al., 2017)。外植体细胞在激素的诱导下, 先产生胚性愈伤组织, 再由愈伤组织细胞形成体胚, 此为间接型(Ikeuchi et al., 2013; Horstman et al., 2017)。而直接型体胚则是由外植体细胞直接形成体胚, 不经过胚性愈伤组织阶段, 体现了细胞发育命运的直接重编程和再分化, 其细胞命运转变的路径相对清晰, 更容易操作和捕捉(Pillon et al., 1996; Raghavan, 2004; Kurczyńska et al., 2007), 是研究细胞命运重编程与细胞全能性的优良模型。本文主要围绕该类型体胚再生体系展开论述。
在早期研究中, 已建立了模式植物拟南芥(Arabidopsis thaliana)以未成熟的合子胚作为外植体, 利用2,4-D诱导子叶再生体胚的直接型体胚再生体系(Raghavan, 2004; Kurczyńska et al., 2007)。通过组织切片等方法, 发现在体胚诱导初期, 子叶表皮细胞开始平周分裂, 经历多轮分裂后最终形成体胚(Kurczyńska et al., 2007)。在水稻(Oryza sativa)胚性愈伤组织诱导过程中也有类似现象, 盾片的表皮细胞在平周分裂后产生了类似胚胎的基细胞和顶细胞结构, 顶细胞分裂形成胚性愈伤组织(Guo et al., 2023)。最新研究发现, 利用LEC2 (LEAFY COTYLEDON 2)诱导表达系统能直接诱导拟南芥子叶的拟分生组织母细胞(meristemoid mother cells, MMCs)转变为体胚, 为体胚再生的单细胞起源理论提供了细胞学直观证据(Tang et al., 2025)。相比之下, 间接型体胚再生体系的细胞来源则多是已分化成熟的细胞, 如叶肉细胞的原生质体(Xu et al., 2021)。有趣的是, 生长素能诱导未成熟胚再生体胚, 也能诱导下胚轴和叶片等产生愈伤组织, 后者具备再生根和芽等器官的能力, 这种再生命运的差异表明植物细胞的多能性依赖于自身原有的细胞属性(Zhai and Xu, 2021; Guo et al., 2023)。
为何未成熟胚的子叶表皮细胞具备直接再生体胚的能力? 通过探究其原因, 发现表观遗传的逐步重编程和激素的内源合成是关键因素。
调控胚胎发生的关键转录因子同样调控体胚再生。例如, 利用BBM (BABY BOOM)和WUS (WUSCHEL)的组合表达作为分子工具, 已实现玉米(Zea mays)和水稻等单子叶植物的胚性愈伤组织发生和体胚再生(Lowe et al., 2016)。在双子叶植物中, LEC1 (LEAFY COTYLEDON 1)-ABI3 (ABA INSENSITIVE 3)-LEC2-FUS3 (FUSCA3 )-BBM (Gazzarrini and Song, 2024)、WOX2 (WUSCHEL-RELATED HOMEOBOX 2) (Wang et al., 2020)、AGL15 (AGAMOUS-LIKE 15) (Harding et al., 2003; Xu et al., 2025)、WUS (Su et al., 2009; Bouchabké-Coussa et al., 2013)和MYB118/MYB115 (Wang et al., 2009)均为体胚再生的关键转录因子, 生长素信号在激活或调控这些转录因子中扮演核心角色。此外, 早期研究表明, 内源生长素合成也为体胚发生所必需(Bai et al., 2013)。
最近一项研究发现, LEC2能诱导拟南芥幼苗子叶表皮上拟分生组织母细胞进入体胚再生过程(Tang et al., 2025)。首先, 他们利用LEC2诱导表达系统, 在拟南芥种子萌发期开始诱导LEC2的表达, 可观察到在子叶上形成体胚。随后, 通过不同时间点的扫描电子显微镜观察, 发现体胚来源于单个子叶表皮细胞, 建立了拟南芥单细胞起源的体胚发生体系。后续利用活体成像技术追踪细胞命运, 发现体胚细胞命运的标记基因SERK1 (SOMATIC EMBRYOGENESIS RECEPTOR KINASE 1)表达滞后于生长素合成基因YUC4 (YUCCA4)和生长素报告基因DR5的表达(Tang et al., 2025)。抑制生长素的内源合成或者在生长素合成相关突变体中, 体胚再生均大幅减弱(Bai et al., 2013; Tang et al., 2025)。单细胞核转录组测序进一步揭示了拟分生组织母细胞的细胞命运转变过程: 当内源生长素合成被激活时, 拟分生组织母细胞逐渐向胚胎属性转变; 当内源生长素合成未被激活时, 则继续分化成为气孔(Tang et al., 2025)。
那么内源生长素如何被激活? 进一步研究发现, LEC2能够与启动气孔发育的关键基因SPCH (SPEECHLESS)在拟分生组织中形成复合体, 进而激活TAA1 (TRYPTOPHAN AMINOTRANSFERASE OF ARABIDOPSIS 1)-YUC4模块, 开启生长素合成(Tang et al., 2025), SPCH突变后体胚将无法形成。这与此前的发现一致(Wójcikowska et al., 2013), 表明外源生长素通过LEC2基因又激活了内源生长素的合成, 生长素-LEC2-生长素正反馈环路的建立是植物细胞重编程的关键。
转录因子通过结合DNA上的顺式元件调控下游基因转录, 该过程依赖于DNA顺式元件序列所处的表观环境。其中DNA甲基化和组蛋白修饰协调染色质开放程度, 影响转录因子对DNA顺式元件的结合(Candela-Ferre et al., 2024)。在拟南芥中的研究表明, 体胚发生过程中的细胞命运重编程依赖于染色质的渐进式开放。生长素通过渐进和级联的方式促进染色质开放, 开启LEC2等细胞全能性基因的表达(Wang et al., 2020)。抑制型组蛋白修饰在胚后发育过程中沉默胚胎基因, 维持细胞分化状态, 是开启细胞重编程的重要障碍。其中H3K27me3是主要抑制型修饰, 介导H3K27me3的PRC2复合体突变后, 拟南芥主根在外源激素的刺激下再生体胚(Ikeuchi et al., 2015; Mozgová et al., 2017)。
在体胚发生早期, LEC2除发挥转录因子的作用外, 还能通过表观遗传重塑调控细胞全能性基因的表达。一方面, LEC2可激活RNA依赖的DNA甲基化 (RNA dependent DNA methylation, RdDM)途径, 增强细胞全能性基因启动子的DNA甲基化程度, 主要是CHH (H代表A、T或C) DNA甲基化。SUVH (SU(VAR)3-9HOMOLOGS)-SDJ (SUVH-INTERACTING DNAJ DOMAIN-CONTAINING PROTEIN)复合体识别这些基因座上的CHH甲基化, 与LEC2形成转录激活复合体(Peng et al., 2025)。SUVH-SDJ进一步招募AHL15 (AT-HOOK MOTIF CONTAINING NUCLEAR LOCALIZED 15), 通过提高组蛋白乙酰化修饰水平(H3K9ac和H3K14ac)促进染色质开放, 维持细胞全能性基因的表达(Peng et al., 2025)。与之一致, 组蛋白去乙酰化酶抑制剂TSA (trichostatin A)通过促进细胞全能性基因的表达提高多种植物的体胚发生能力(Li et al., 2014; Wójcikowska et al., 2018; Nowak et al., 2024)。
综上, 胚胎时期的染色质状态有利于LEC2功能的发挥(图1), 这可能是外源生长素激发细胞全能性的前提条件。无独有偶, 在动物细胞中, 利用化学小分子调控表观遗传途径和信号转导, 也能将体细胞重编程为多能干细胞(pluripotent cell) (Chen et al., 2023; Wang et al., 2025)。这表明动、植物细胞的多能性与全能性均受表观遗传调控, 而如何克服表观遗传障碍是人为操纵细胞命运转变的关键。
目前的研究揭示了拟南芥中单个子叶拟分生组织细胞重编程为胚胎细胞的发育轨迹和机制, 这为改良作物体胚再生体系提供了契机, 通过操控重编程关键调控节点, 有望突破作物遗传转化的瓶颈。但目前LEC2-SPCH仅能诱导特定的细胞形成体胚, 这是否意味着LEC2-SPCH依赖这些特定细胞中表达的某些关键转录因子或染色质重塑因子? 尽管已经挖掘出一些候选基因, 但这些候选基因的功能尚未得到验证, 进一步验证这些关键基因的功能并揭示其调控机制, 将有望诱导更多细胞类型形成体胚。同时, LEC2-SPCH诱导体胚形成的能力在其它物种中是否保守仍有待验证。此外, 已分化的组织和器官可以产生胚性愈伤组织间接再生体胚, LEC2调控胚性愈伤组织的再生机制也有待进一步探究。
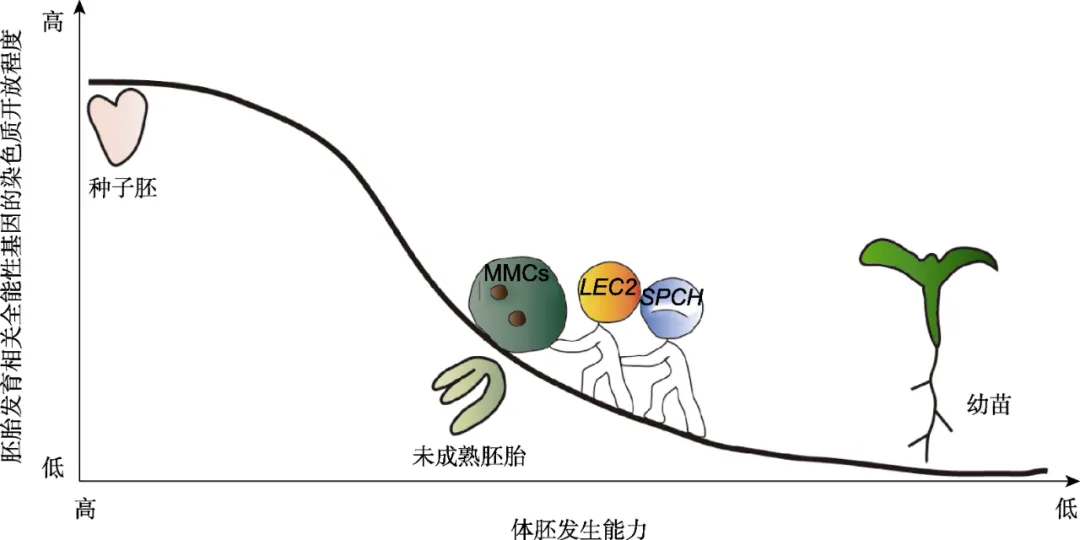
图1 体细胞胚再生能力由胚胎相关全能性基因的染色质开放程度决定
在植物胚胎发育和种子萌发过程中, 随着胚胎发育相关细胞全能性基因座的染色质逐渐关闭, 体胚再生能力逐渐丧失。然而, 关键转录因子组合能够突破这种限制, 通过在特定的染色质环境下对体细胞进行重编程, 从而诱导其转化为体胚。图示LEC2-SPCH基因模块将幼苗子叶表皮的拟分生组织母细胞(MMCs)转变为体胚。
Figure 1 The competence for somatic embryogenesis is governed by the chromatin accessibility of totipotency-related genes
During plant embryonic development and seed germination, the chromatin states at the loci of embryogenesis-associated totipotency genes become progressively silenced, leading to a corresponding decline in the capacity for somatic embryogenesis. Key transcription factor combinations can overcome this limitation by reprogramming somatic cells within specific chromatin contexts, thereby inducing their conversion into somatic embryos. This figure illustrates how gene modules, such as LEC2-SPCH, can redirect the fate of meristemoid mother cells (MMCs) in the cotyledon epidermis to form somatic embryos.
作者贡献声明
李子娟: 论文构思、撰写、修改和绘图; 徐麟: 论文构思及修改。
引用本文
李子娟, 徐麟 (2026). 从单个体细胞到全能胚胎: 细胞命运的重编程之旅. 植物学报 61, 1–6. doi: 10.11983/CBB25176. (点击链接下载文章PDF)
通讯作者/团队介绍
徐麟, 中国科学院分子植物科学卓越创新中心, 研究员, 博士生导师。主要从事植物干细胞与再生研究, 在再生伤口信号转导和再生细胞命运转变机制等方面取得一系列研究进展。研究成果以独立通讯及共同通讯作者发表在Nature Plants、Current Biology、Molecular Biology and Evolution、The Plant Cell、Development、Cell Reports等国际著名期刊上。目前其研究团队以模式植物和经济作物为研究材料, 不仅聚焦于阐明组织培养、扦插、嫁接等过程的再生机制, 更致力于从中提炼关键的分子工具, 以推动植物再生技术的研发。
来源:植物学报微信


 会员注册
会员注册 会员登录
会员登录