2025年9月12日是第21个预防出生缺陷日,出生缺陷是由于遗传因素和(或)不良环境因素导致的胎儿结构或功能异常,是导致流产、死胎、婴幼儿死亡和先天残疾的主要原因。我国是出生缺陷高发国家,每18名宝宝中就有1名存在出生缺陷,出生缺陷发生率高达5.6%。其中50%左右的出生缺陷与遗传因素相关,包括染色体异常(染色体病)和基因突变(单基因病)。由遗传因素导致的出生缺陷多数严重致死、致畸、致残,且无有效治疗手段,关键在于预防!产前遗传学筛查通过分析胎儿的染色体和基因状态,了解胎儿是否患有染色体病或基因病,是预防出生缺陷发生的重要手段!
产前遗传学筛查---染色体病和显性单基因病(新发突变)
产前遗传学筛查是指基于孕妇外周血生化指标或游离 DNA 来评估胎儿罹患染色体病和单基因病风险。染色体病,包括 13、18、21 三体以及微缺失微重复综合征等,人群发生率超过 1%,约 90%以上属于新发变异。单基因病是除染色体病外导致出生缺陷的另一主要原因,综合发病率约 1%,显性单基因病在单基因遗传病中的占比超过 50%,其中约 74%的病例由新发突变引起。这些疾病大多缺乏有效的治疗方法,通过产前筛查和诊断是预防这些出生缺陷最有效途径。
01 唐 筛
唐筛,即唐氏血清学筛查,是在孕15-20^+6^周抽取孕妇外周血,通过检测母体血清中生化标志物,并结合孕妈妈的年龄、体重、孕周等信息来计算胎儿患21三体综合征、18三体综合征和开放性神经管畸形的风险。
唐筛的优势在于价格实惠,很多地方政府已经纳入惠民项目。但它的局限性也很明显:
①检测范围有限:只能检测18-三体、21-三体和神经管缺陷;
②不做唐筛不放心,做了筛查低风险也不放心:针对唐氏综合征的检出率约80%,也就是说,约20%的唐氏儿会被漏检;
③筛查高风险不敢不做羊水穿刺,但做了多数都正常:唐筛假阳性率约5%,阳性预测值1%——2%。即每1000个做唐氏筛查的孕妇中有50个被评为高风险,50个唐筛高风险孕妇通过产前诊断最终被确诊怀有唐氏儿的孕妇约1个,其余49个均为虚惊一场。
在大家越来越重视孕妇及宝宝健康的今天,更准确、更精准的筛查手段成为医生和孕妇的迫切需求,在此背景下,无创DNA检测应运而生。
02 无创DNA检测(NIPT)
1997年,香港中文大学卢煜明教授团队发现,母体外周血中存在游离胎儿DNA,为无创产前检测技术的临床应用奠定了坚实的理论基础。无创DNA检测(NIPT 1.0)是在孕12-22^+6^周抽取孕妇外周血,通过高通量测序方法检测血浆中的胎儿游离DNA,再通过生物信息学分析计算胎儿患21、18、13三体综合征的风险。相比唐筛,NIPT的检出率和准确性更高,针对这三种染色体异常,NIPT的特异性大于99%,假阳性率低于1%,目前国际国内指南都推荐NIPT可作为所有孕妇的一线筛查手段。
随着技术发展的日新月异,无创DNA检测有了升级版(NIPT plus版/2.0版)。在原有NIPT1.0版本的基础上,通过加深测序深度,NIPT 2.0的检测范围拓展到全基因组的23对染色体非整倍体异常以及一些常见的染色体微缺失/微重复综合征。目前的研究结果显示,NIPT 2.0针对非常见染色体三体异常及染色体微缺失/微重复综合征的敏感性虽然不如常见的13三体、18三体和21三体,但仍能达到75%以上.
传统的无创产前检测技术(如NIPT和NIPT2.0)主要针对染色体异常进行筛查。随着孕龄夫妇生育年龄的增长,尤其是父亲年龄的增长,由显性单基因病新发变异引发的遗传疾病发病率逐渐上升。为了应对这一挑战,采用目标测序捕获技术的新一代无创产前检测方法------即NIPT3.0版本应运而生。NIPT3.0作为一种一种科学、快速、准确的产前检测手段可以一次性筛查184种遗传病包括15 种染色体非整倍体、15 种 染色体微缺失综合征和 154 种显性单基因病,实现了无创产前胎儿染色体非整倍体、染色体微缺失综合征及单基因疾病的联合筛查。
单基因遗传病携带者筛查
在临床实践中,隐性单基因遗传病与显性单基因疾病一样,都是导致单基因遗传疾病发生的关键因素之一。我们每个人都是单基因病致病变异携带者(针对437个基因的研究显示,每个个体平均携带2.8个致病变异),携带者表型正常,但如夫妻同时携带相同基因致病变异(常染色隐性遗传)或女方携带X染色体致病变异,则后代就有1/4及以上可能患病。孕前或孕早期进行单基因病携带者筛查,提早发现高风险夫妻,是预防此类疾病发生的主要方式。
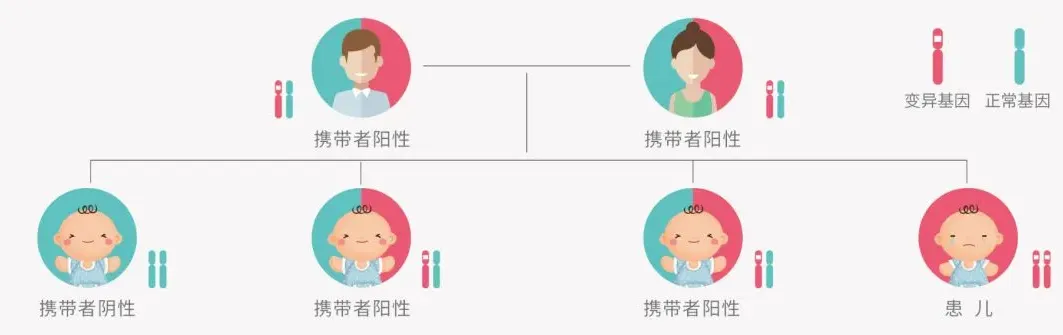
01 运动神经元存活基因1(SMN1)外显子缺失检测
2021年年底,国家医保局的"灵魂砍价",让脊髓性肌萎缩症(Spinal Muscular Atrophy,SMA)走进了更多人的视线。SMA是一类由脊髓前角运动神经元变性导致的神经肌肉疾病,主要表现为肌肉近端对称性、进行性肌无力,是最常见的遗传性退行性神经肌肉疾病之一,发病率约为1/6000-1/20000,人群携带频率约为1/40-1/60。SMA是一类由脊髓前角运动神经元变性导致的神经肌肉疾病,主要表现为肌肉近端对称性、进行性肌无力,是最常见的遗传性退行性神经肌肉疾病之一,发病率约为1/6000-1/20000,人群携带频率约为1/40-1/60。虽然"灵魂砍价"后SMA治疗药物的费用已大幅下降,但患者的终生治疗费用对大部分家庭而言仍然十分昂贵,且患者的治疗为修正治疗不能根治,因此,SMA携带者筛查仍然是预防该病最有效的方式。
由于高发病率和疾病的严重性,国内外指南均推荐对人群进行SMA的携带者筛查,以促进生育的知情选择。约95%的SMA患者是由于SMN1基因第7外显子纯合缺失所致,通过对SMN1基因7号外显子的缺失检测,可大幅降低SMA的发生风险。
02 地中海贫血常见变异检测
地中海贫血(简称 "地贫"),是由于珠蛋白基因缺陷导致珠蛋白肽链合成不足引起的遗传性溶血性贫血。作为常染色体隐性遗传病,当夫妻双方均为携带者时,子代患病风险显著增加。地中海贫血最早见于地中海沿岸地区,伴随人口迁移,现已广泛分布于全球各个国家、地区。我国地中海贫血基因携带率为1%-24%,主要集中在长江以南省份。地贫基因致病变异的携带者筛查,可有效降低子代地中海贫血的发生风险。
地中海贫血常见基因变异检测覆盖缺失型α-地中海贫血、非缺失α-地中海贫血以及β-地中海贫血相关基因的27个常见变异,可有效检测人群中超过95%的携带者。
03 脆性X综合征(FXS)筛查
FXS是一种常见的遗传性智力障碍,其发病率仅次于唐氏综合征。该病主要表现为智力发育迟缓、语言障碍、行为异常及自闭症谱系障碍等特征,且男性患者症状通常比女性更严重。
95%以上的FXS是由于FMR1基因(CGG)n重复序列扩增导致的一种X连锁不完全显性遗传病。由于女性拥有两条X染色体,因此即使携带了突变型FMR1基因,也可能因另一条未受影响的X染色体的补偿而表现出较轻微的症状。目前对于FXS尚无特效治疗方法,临床上主要通过采取多种干预措施来管理症状并提高患者的生活质量。因此,育龄夫妇可通过FXS携带者筛查,明确其生育FXS患儿的遗传风险,从而采取相应措施以防止此类遗传病患儿的出生。
04 扩展性携带者筛查(ECS)
扩展性携带者筛查(ECS),是除SMA、地贫等外,将检测范围进一步扩展至人群高发的多种隐性单基因病,通过高通量测序技术,一次检测实现对多种单基因遗传病的筛查,以较低的成本获得更高的筛查效率。目前,绝大部分权威学会建议对所有有生育需求的女性及其配偶进行扩展性携带者筛查,无需考虑家族史。
目前我院开展的ECS包括以下2种:
1)100+种单基因遗传病携带者筛查:采用二代靶向捕获测序技术,针对147个基因相关的149种单基因遗传病进行筛查。
2)400+种单基因遗传病携带者筛查:为了最大程度地检出遗传病携带高风险夫妇,400+种单基因遗传病携带者筛查在100+扩展性携带者筛查基础上进一步优化,覆盖442个基因相关的501种单基因遗传病,同时还进行额外的专项检测,包括脆性X综合征相关FMR1基因(CGG)n重复数目及男性Y染色体微缺失。
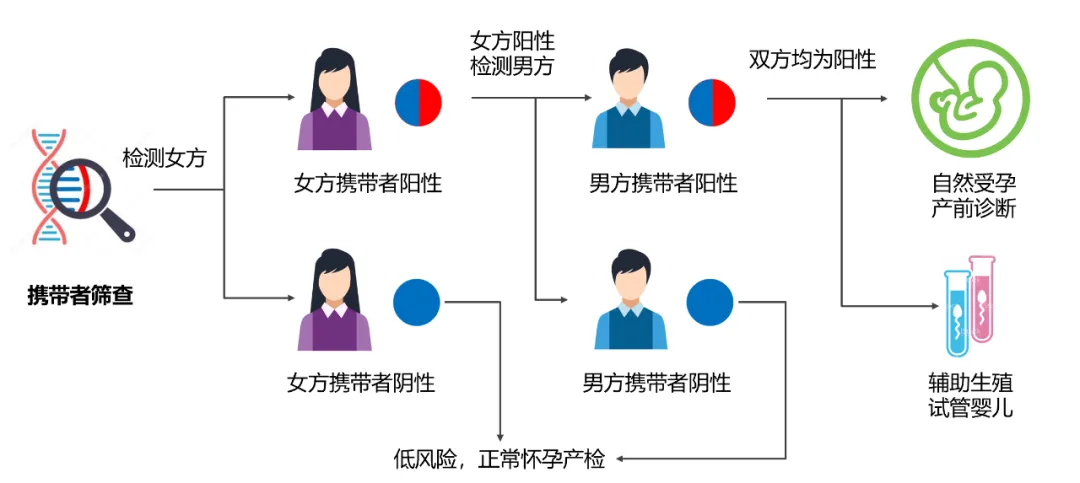
携带者筛查检测只需要抽取夫妻3-5ml的外周血即可,具体流程如图2所示。一般建议在孕前或孕早期(<16周)进行筛查,建议先筛查孕妇,孕妇筛查阳性再筛查丈夫。但是如果孕周>16周,考虑给后续可能的产前诊断干预预留时间,一般建议夫妻双方同时进行筛查,以便尽快获得结果。
产前遗传学筛查注意事项及结语
再次强调,上述所有的产前遗传学筛查项目均采取外周血样本,且无需空腹!!!孕妈妈们可以放心吃早餐,不要饿到自己和宝宝们哦——
最后说一句,产前筛查不是万能的,它只是帮助我们排除掉大部分产前可以检出的出生缺陷问题,筛查疾病的范围也是有限的。所以,筛查低风险也一定不要掉以轻心,还是要定期产检,而筛查高风险则要配合医生进行更准确的产前诊断。
供稿:中国福利会国际和平妇幼保健院生殖遗传科副主任李淑元提供
来源:上海市出生缺陷预防保健中心公众号


 会员注册
会员注册 会员登录
会员登录