胰腺导管腺癌是最常见、也是最致命的胰腺癌类型,被称为“癌王”。患者一经确诊,一年生存率仅约 25%,五年生存率更是不足 5%。其高度异质性和复杂的肿瘤微环境使治疗极具挑战性。
研究发现,胰腺癌中存在两类典型细胞亚群:进展相对缓慢的上皮肿瘤细胞,以及更具侵袭性、易转移且耐药性强的间质肿瘤细胞,而后者正是导致胰腺癌预后极差的主要原因。
早在 2022 年,张常华教授团队与 Axel Behrens 院士团队就在 Nature 期刊发表论文,发现了间质细胞分泌的 GREM1 蛋白能维持上皮细胞状态,然而,是否存在决定间质细胞命运的关键分泌因子,仍是亟待解决的科学问题。
中山大学附属第七医院张常华教授团队联合中山大学物理学院物理力学与生物物理研究中心林绍珍教授、英国癌症研究院 Axel Behrens 院士团队,在国际顶尖学术期刊 Nature 上发表了题为:SPP1 is required for maintaining mesenchymal cell fate in pancreatic cancer 的研究论文。

该研究首次揭示了骨桥蛋白(Osteopontin,也叫做SPP1)、BMP2 和 GREM1 在调控胰腺癌细胞命运中的核心作用,并提出靶向抑制骨桥蛋白以逆转胰腺癌进展的创新治疗策略。
意外发现:骨桥蛋白的“反常”表达
通过比较早期与晚期胰腺癌患者的血清,研究团队发现,骨桥蛋白水平在晚期显著升高。更有趣的是,骨桥蛋白在婴幼儿血浆中含量极高,约为成人的 7–10 倍,提示它与发育密切相关。为何这种“幼年蛋白”会在晚期胰腺癌中重新激活?
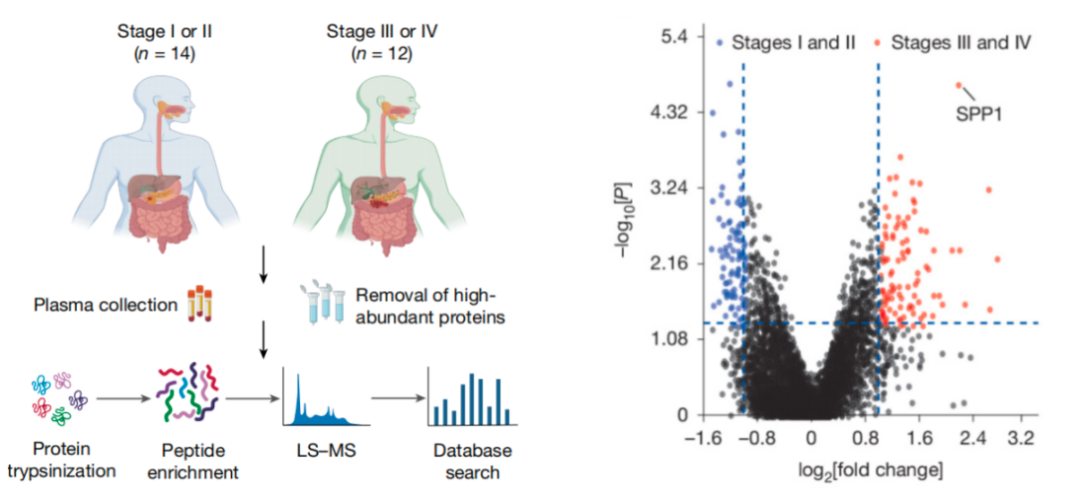
图1:早期(I期或II期)与晚期(III期或IV期)胰腺癌患者血浆蛋白组学检测
骨桥蛋白的表达与患者的预后显著相关
通过对 24 例胰腺癌患者和 11 例正常胰腺标本的单细胞测序分析,研究团队发现,SPP1 高表达的细胞与 EMT 发生关系更为紧密。进一步分析公共数据库中 644 份人类胰腺癌样本数据发现,SPP1 水平较高的患者预后明显更差。这表明骨桥蛋白不仅是一个标志物,更可能直接参与肿瘤进展及可塑性调控。
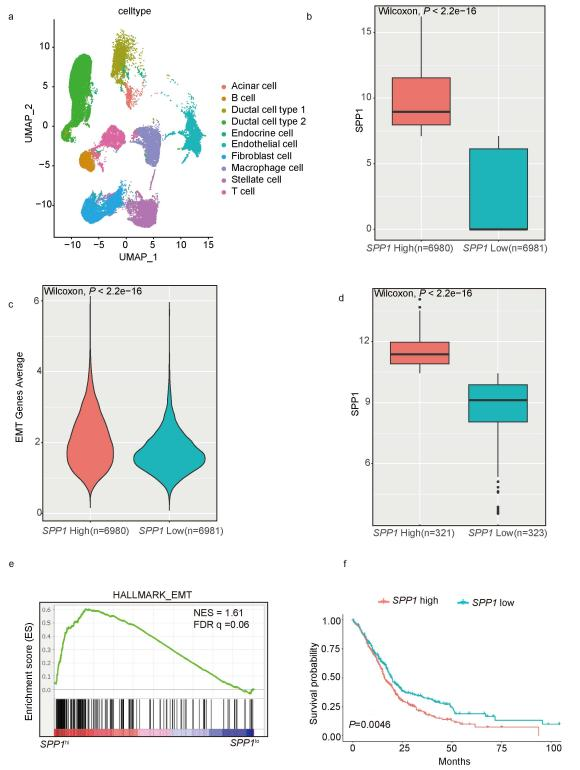
图2:人胰腺导管腺癌单细胞RNA测序,SPP1高表达人群基因富集和生存分析
基因工程小鼠模型揭示骨桥蛋白的功能
科学家们长期探索能够替代人体实验的手段,而小鼠模型是研究肿瘤发生发展的重要工具。英国癌症研究院的 Axel Behrens 院士是最早构建基因工程小鼠并利用其研究肿瘤的权威专家。为研究骨桥蛋白在胰腺癌中的作用。研究团队首次构建了 KPFV 基因工程小鼠,通过基因工程的手段,将 KrasFSF-G12D,Trp53FRT, Pdx1-FLP 以及 Vimmentin-GFP 等片段整合入小鼠基因组。由于 Pdx1 在胰腺细胞中特异表达,该小鼠模型能够特异性激活 KrasFSF-G12D和 Trp53FRT突变并诱导胰腺癌发生;同时,Vimentin-GFP 可标记间质细胞。借助这一模型和类器官培养,研究团队利用 CRISPR-Cas9 敲除骨桥蛋白,结果发现间质肿瘤细胞(Vimentin-GFP)完全消失,类器官在小鼠体内成瘤率明显下降。
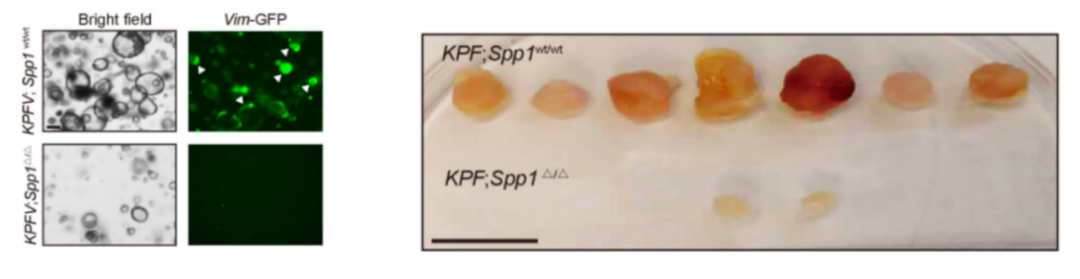
图3:Spp1-/- KPFV与Spp1wt/wt KPFV小鼠类器官的免疫荧光和皮下瘤图像
在另一种 KPCY 基因工程小鼠中,研究团队通过免疫荧光示踪发现,骨桥蛋白仅在上皮肿瘤细胞中表达,却能显著影响间质细胞命运。进一步构建 Spp1fl/fl KPCY 小鼠后发现,原本 30 天内即可发生胰腺癌、60 天因为胰腺癌死亡的小鼠,在骨桥蛋白敲除后可存活超过 400 天,几乎阻断了肿瘤进展。

图4:Spp1fl/fl KPCY 小鼠建模,Spp1wt/wt KPCY和Spp1fl/fl KPCY小鼠的生存曲线
为克服胚胎期敲除的局限性,研究团队创新性建立了 KPFCT 小鼠模型。该模型可在肿瘤形成后通过他莫昔芬诱导沉默骨桥蛋白。结果显示,即使在肿瘤已发生的情况下,沉默骨桥蛋白仍能有效延长小鼠寿命并抑制远处转移,进一步验证了骨桥蛋白作为治疗靶点的潜力。
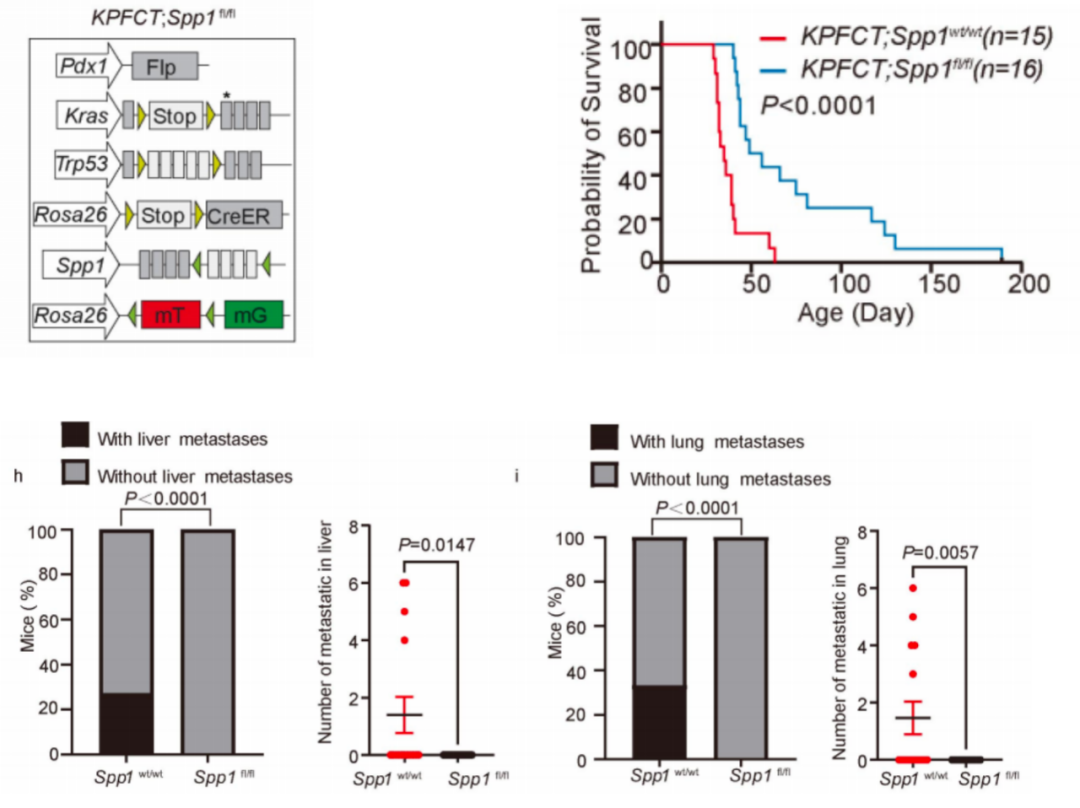
图5:Spp1fl/fl KPFCT 小鼠建模,Spp1wt/wt KPFCT和Spp1fl/fl KPFCT小鼠的生存曲线和肝肺转移发生率和数量统计
骨桥蛋白和Grem1是上皮肿瘤细胞和间质肿瘤细胞沟通的“电报”
通过前面的研究结果,可以得出结论是骨桥蛋白能够通过影响间质肿瘤细胞的命运,进而调控胰腺癌的进展。但是为何间质肿瘤细胞不直接分泌骨桥蛋白?这样不是更加直接有效吗?
为了探索其中的机制,研究团队发现,骨桥蛋白的受体居然在间质肿瘤细胞上,这个受体叫做 Cd61。骨桥蛋白能够结合间质肿瘤细胞的膜受体 Cd61,从而激活细胞内的 NF-κB 信号通路。进而激活 Bmp2 的转录表达。而 Bmp2 能够激活 SMAD 信号通路,从而激活 Bmp2 自身以及 Grem1 的转录表达。而研究团队前期的研究表明,Grem1 是从间质肿瘤细胞分泌,并维持上皮肿瘤细胞的命运。现在,研究团队发现,上皮肿瘤细胞分泌骨桥蛋白来维持间质肿瘤细胞的命运。这说明上皮肿瘤细胞和间质肿瘤细胞存在一种微妙的沟通“电报”。而这个“电报”的“摩斯密码”就是骨桥蛋白和 Grem1。

图6:胰腺癌中Spp1、Bmp2和Grem1维持细胞异质性的作用机制模型
细胞命运的“三体问题”:Spp1–Bmp2–Grem1的复杂调控网络
研究团队发现,上皮肿瘤细胞和间质肿瘤细胞通过 Spp1 和 Grem1 进行双向调控。它们不单止是进行简单的“嘘寒问暖”,而是通过“摩斯密码”来进行信息沟通并影响相互之间的命运。上皮肿瘤细胞通过“发号”骨桥蛋白“指挥”间质肿瘤细胞,而间质肿瘤细胞通过“反馈” Grem1 来“指挥”上皮肿瘤细胞。
研究发现,Spp1 激活 Bmp2,从而促进 Bmp2 和 Grem1 的转录。但 Bmp2 同时抑制 Spp1,而 Grem1 又抑制 Bmp2。Spp1 和 Bmp2 能够影响间质肿瘤细胞的命运,而 Grem1 能够影响上皮肿瘤细胞的命运。“牵一发而动全身”,这三个蛋白只要发生微量的改变,将影响整个胰腺癌细胞亚群的改变。三者构成动态平衡分子网络,共同决定肿瘤的侵袭特性。
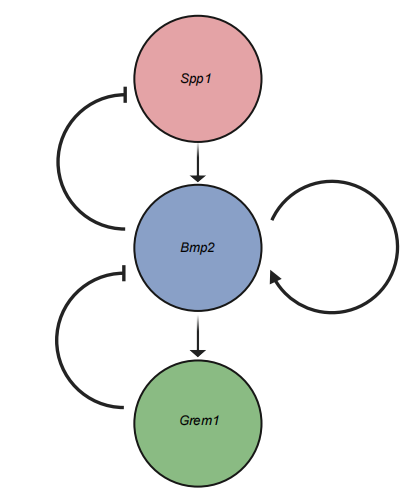
图7:Spp1、Bmp2和Grem1三者相互调控的关系
为验证该机制,研究团队历时四年构建了可时空诱导双敲除 Spp1 与 Grem1 的小鼠模型,整合了多达 7 个基因修饰。实验结果显示:单独敲除骨桥蛋白使肿瘤偏向上皮表型,单独敲除 Grem1 则肿瘤间质特征增强;双敲除则进一步推动间质化。不同顺序的敲除或过表达实验也验证了三者间的动态依赖关系,充分证实了这一生物学“三体系统”的存在。
临床应用:靶向骨桥蛋白的治疗潜力
研究人员通过遗传学模型验证靶向干预的疗效:在胚胎期敲除骨桥蛋白可显著延缓胰腺癌发生;更重要的是,在已形成肿瘤的成年小鼠中敲除该基因,依然可显著抑制肿瘤进展、延长生存期,并几乎完全阻遏肝肺转移。
基于这一发现,研究团队进一步构建与人类胰腺癌突变类似的胰腺癌基因工程小鼠KPR172H/+CY。该模型更接近人类胰腺癌的常见突变背景,能真实模拟转移过程。在这一模型中,使用靶向骨桥蛋白的单克隆抗体治疗,显著延长了小鼠寿命并抑制转移,且未观察到明显毒副作用。由于分泌蛋白更易被抗体靶向且副作用较小,该策略具有较高的临床转化潜力。
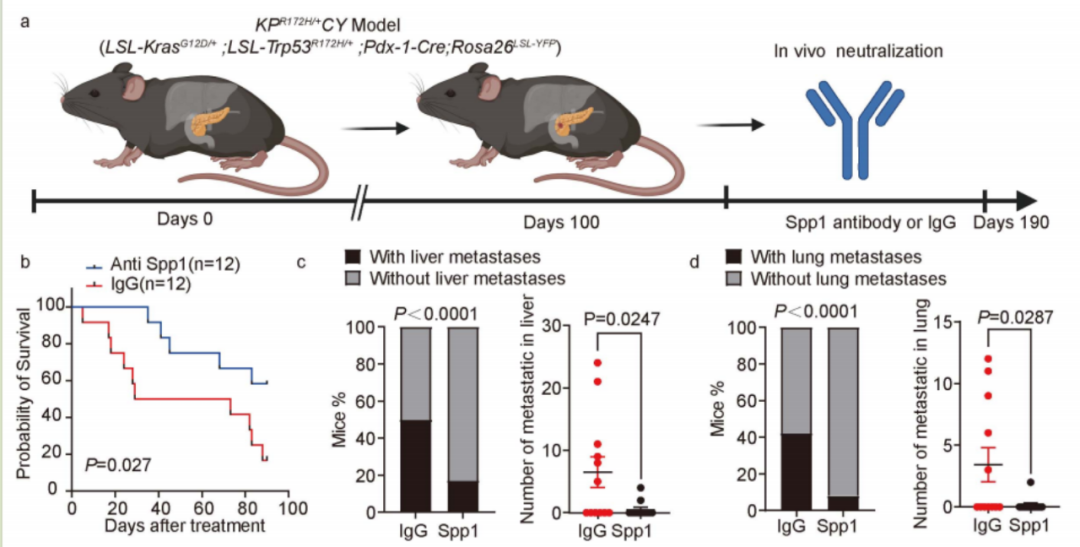
图9:KPR172H/+CY 模型中Spp1中和实验方案示意,经Spp1抗体或IgG对照处理的KPR172H/+CY小鼠生存分析、肝肺转移发生率和数量统计
多学科合作攻克科学难题
该研究融合了临床医学、生物物理学与分子生物学等多学科优势,突破单一领域的认知局限,通过精巧的实验设计与模型构建,阐明了胰腺癌细胞命运的核心调控机制。这不仅深化了对胰腺癌生物学的理解,也为未来开发新型治疗策略提供了重要理论与实验依据。
英国癌症研究院终身高级科学家(Staff scientist)李华福博士,中山大学附属第七医院蓝林祥研究员和中山大学附属第七医院陈恒星特聘研究员为共同第一作者;张常华教授和 Axel Behrens 院士为共同通讯作者。研究得到国家自然科学基金和广东省消化系统恶性肿瘤防治研究重点实验室等基金的资助。
原文链接:
https://www.nature.com/articles/s41586-025-09574-y
来源:微信公众号生物世界
年会学术预告——张常华研究员

报告题目:LDHA抑制剂司替戊醇在消化道恶性肿瘤的应用研究
报告时间:2025年10月22或23上午(暂定)
个人介绍

张常华中山大学附属第七医院党委委员、副院长、胃肠外科学科带头人
以通讯作者身份在《Nature》主刊发表论文,成果入选2024年度中国生命科技十大进展及丁香学术2024年十大科学突破。荣获研究型医院研究型人才、广东医院优秀管理奖、深圳医师奖、南粤好医生等称号,连续六年入选《岭南名医录》。2024年、2019年作为项目负责人获得深圳市医疗卫生“三名工程”项目。主持市级以上科技项目14项,包括国家自然科学基金项目3项,省企联合重点项目1项、省团队1项和深圳市重点项目2项。发表论文300余篇,其中在Nature(2篇)、Gut、Gastroenterology、Clinical Cancer Research等期刊发表原创性高水平论文182篇,获得发明专利6项,获广东省科技进步奖一等奖、广东省科学技术奖二等奖,中华医学科技进步奖三等奖和广东省医学科技奖各1项。主编《胃癌知识知多少》、《肠癌知识知多少》、《腹痛原理与诊断》,副主编《胃癌淋巴结转移》。
报告摘要
Warburg效应描述了肿瘤细胞在有氧条件下仍偏好无氧糖酵解的代谢异常。自1923年发现以来,其生物学意义百年未解。一个关键谜团是:该效应所致的乳酸堆积,究竟如何通过影响DNA修复等过程介导化疗耐药,目前仍不清楚。
DNA修复蛋白乳酸化介导肿瘤耐药新机制
2024年7月3日,中山大学附属第七医院何裕隆、张常华教授团队联合中外合作单位,于《Nature》发表研究,揭示乳酸通过介导NBS1蛋白的乳酸化修饰促进DNA修复、诱发化疗耐药的关键机制。该发现为克服肿瘤耐药提供了新的治疗策略与靶点。

研究团队通过蛋白质组学与代谢组学分析发现,胃癌化疗耐药组织的糖酵解通路异常活跃,乳酸水平显著升高。体内外实验证实,乳酸可削弱化疗疗效,并增强DNA同源重组修复(HRR)能力,从而促进耐药。进一步研究揭示,乳酸通过乳酸化修饰调控DNA修复关键蛋白NBS1的功能:TIP60在乳酸存在时可催化NBS1第388位赖氨酸发生乳酸化修饰,该修饰促进NBS1与MRE11结合形成MRN复合体,加速DNA损伤修复;而去乳酸化酶HDAC3则反向调控此过程。耐药细胞中乳酸主要来源于LDHA的高表达。临床数据表明,LDHA与NBS1乳酸化水平在耐药肿瘤中同步上升,且与患者不良预后相关。利用已获批药物司替戊醇抑制LDHA活性,可有效降低NBS1乳酸化水平,破坏DNA修复能力,在类器官和小鼠模型中显著增强顺铂或放疗的抗肿瘤效果。该研究阐明了乳酸-NBS1乳酸化-DNA修复轴在化疗耐药中的关键作用,已获三项专利,并为逆转耐药提供了新靶点,并提示司替戊醇具有临床转化潜力。
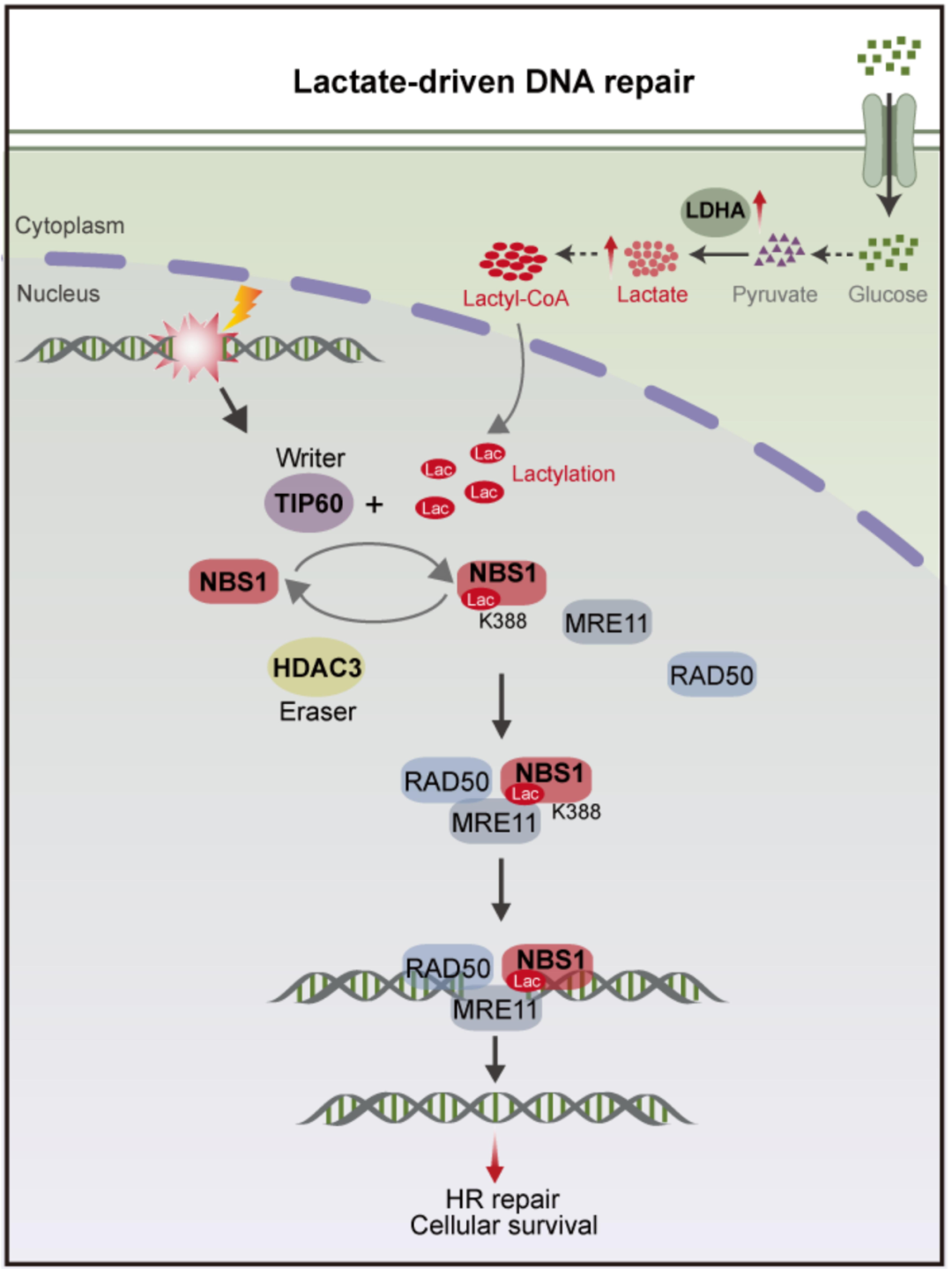
从实验室到临床:靶向乳酸代谢增强肿瘤治疗新策略
团队自2024年4月起积极推进前述科研成果的临床转化,目前进展顺利。在晚期腹膜转移癌患者中开展的初步临床研究显示,司替戊醇联合免疫靶向化疗方案安全性良好,入组的6例常规治疗无效患者均未出现与司替戊醇相关的严重毒副反应,并展现出抗肿瘤潜力。
进一步在细胞及PDX模型中验证,司替戊醇可增强铂类药物的抗肿瘤效果,并上调胃癌细胞PD-L1表达。基于此,团队拟近期启动一项I期临床试验,评估司替戊醇联合免疫化疗在初治晚期胃癌患者中的疗效与安全性,并同步开发配套生物标志物快速检测技术,以期通过靶向代谢途径突破治疗瓶颈,为患者提供新希望。


 会员注册
会员注册 会员登录
会员登录